今回は、化学電池と化学変化についての学習です。
化学電池のポイント
化学電池とは、物質がもつ化学エネルギーを電池エネルギーに変えるしくみです。
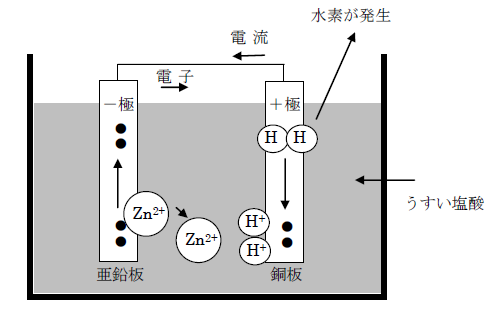
- <-極での反応>亜鉛電子が2個の電子を放出して溶けだし、亜鉛イオンになります。
- <+極での反応>水素イオンが電子を受けとり、水素原子となり、2個の水素原子が結びついて水素分子となります。
電池をつくる実験
- 食塩水か、うすい塩酸に、銅板と亜鉛板を入れ、銅板(+)、亜鉛版(-)に、電子オルゴールをつなぐ。すると、オルゴールが鳴り、電池になったことが確認できた。
- +と-の極を逆にすると、電子オルゴールはならず、電池はできないことがわかる。
- 同じ種類の金属の組み合わせだと、電子オルゴールはならず、電池はできないことがわかる。
イオン化列
金属をイオン化傾向の大きい順に並べたもの。
組み合わせる金属が離れているほど、電池としてはいい。たとえば、 Mg(マグネシウム)とCu(銅)の組み合わせだと離れているので、はっきりと音がでます。しかし、Mg(マグネシウム)とZn(亜鉛)だと近くなり、はっきり音はしても、曲として聞きづらくなります。この場合、Zn(亜鉛)が右にあるので、+極になります。
いろいろな電池
- 二次電池…充電をし繰り返し使うことのできる電池で、鉛蓄電池などがあります。なお、充電できない電池を一次電池といいます。
- 燃料電池…水の電気分解とは逆の化学変化(水素と酸素の化合)を利用する電池です。
化学電池と化学変化の練習問題
問1( )に適語を入れよ。
(1)( )エネルギーを電気エネルギーに変えて取り出す装置を電池という。
(2)電池には( )種類の金属と電解質水溶液が必要である。
(3)亜鉛板と銅板を使って電池を作る場合、陰極になるのは( )である。
(4)燃料電池とは( )の逆の化学反応を利用して電気エネルギーを取り出す装置である。
(5)二次電池とは( )できる電池のことである。
問2 図は、うすい塩酸に亜鉛板と銅板を入れて導線でつないだとき、亜鉛板の亜鉛原子が電子を放出して、亜鉛イオンになり、電子が導線を通って銅板側に動く、化学電池のしくみを表しています。次の問いに答えなさい。
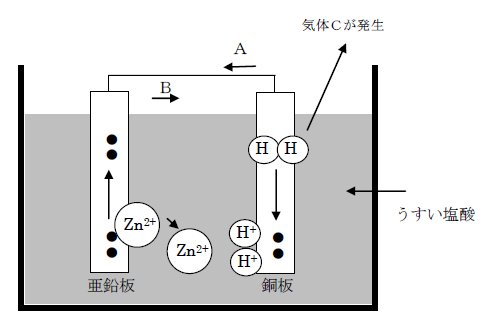
(1)電流の向きは、図のA、Bのどちらか。
(2)銅板で電子を受けとるのは、何イオンか。
(3)銅板で発生している気体Cは何か。化学式で書きなさい。
(4)図で、+極になっているのは、亜鉛板と銅板のどちらか。
化学電池と化学変化の練習問題の解答
【問1】
(1)化学
(2)2
(3)亜鉛板
(4)水の電気分解
(5)充電
【問2】
(1)A
(2)水素イオン
(3)H2
(4)銅板


コメント