酸性・アルカリ性の性質を理解するうえで欠かせないのが、「電離」と「pH」の考え方です。本記事では、中学3年生の理科で行う pH試験紙(リトマス紙)を使った酸・アルカリの実験のポイントを、はじめての人でも分かりやすいように整理しました。実験の目的、確認すべき変色、注意点など、テストでよく問われる内容もまとめています。実験前の予習や定期テスト対策にぜひ活用してください。
酸とアルカリの電離と pH 試験紙(リトマス紙)実験
酸性・アルカリ性を調べるには、リトマス紙や pH 試験紙を使う実験がよく行われます。しかし「色が変わるだけ」と思わずに、なぜ色が変わるのか・なぜしみが極の方向へ動くのかまで理解すると、入試問題や実験レポートで大きな差がつきます。ここでは、酸とアルカリの電離のしくみから、実験の手順・観察・注意点までを詳しく、わかりやすく解説します。
1. 酸とアルカリの電離とは?
酸やアルカリは水に溶けると イオンに分かれる(電離) 性質があります。これが酸性・アルカリ性の正体です。
- 酸(例:塩酸) → 水素イオン
H+を生じる - アルカリ(例:水酸化ナトリウム) → 水酸化物イオン
OH-を生じる
これらのイオン(H+ や OH-)が電気を帯びているため、電場をかけると移動します。この移動が試験紙の色の変化やしみの向きに関係しています。
2. 酸(塩酸)を使った実験:赤いしみが陰極へ動く
以下の図は塩酸を中央に置いて電圧をかけたときの実験例です。
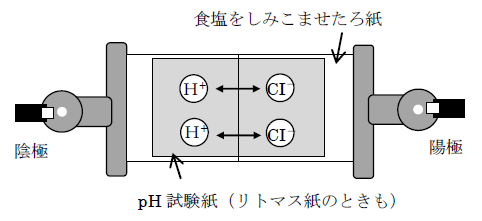
観察結果:赤色のしみが陰極側(−極)へ移動しました。陽極側は変わらず緑色のままです。
HCl → H+ + Cl–
解説:塩酸は電離して H+(水素イオン)を出します。H+ は正の電荷を持つため、負の電荷を持つ陰極(−極)へ引かれて移動します。これにより、試験紙上のしみが陰極側へ寄る・色の変化が起きます。
3. アルカリ(NaOH)を使った実験:青いしみが陽極へ動く
次に水酸化ナトリウム(NaOH)を中央に置いて電圧をかけた場合です。
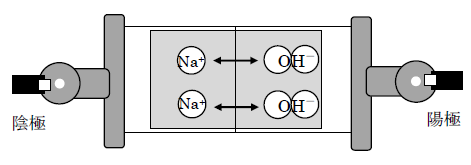
観察結果:青色のしみが陽極側(+極)へ移動しました。陰極側は変色しません。
NaOH → Na+ + OH–
解説:NaOH は電離して OH-(水酸化物イオン)を生じます。OH- は負の電荷を持つため、正の電荷を持つ陽極(+極)へ引かれて移動します。これが青いしみが陽極側へ移動する理由です。
4. リトマス紙を使った総合的な実験(入試でよく出る形式)
入試では赤色リトマス紙と青色リトマス紙を同時に用い、電圧をかけたときのどの紙がどの極でどの色に変わるかを答えさせる問題がよく出ます。下図はその模式図です。
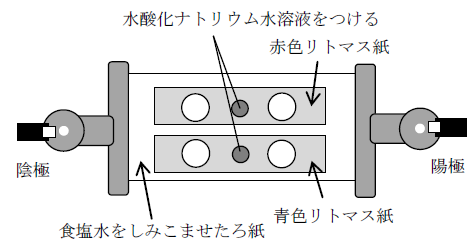
たとえば、水酸化ナトリウム を使った場合は次のようになります。
- 水酸化ナトリウムはアルカリ性 → 赤色リトマス紙が青に変化
OH-は負の電荷なので陽極(+極)へ移動 → 陽極側の赤色リトマス紙が青に変わる(図の右上の○)
反対に、塩酸 を使うと:
- 塩酸は酸性 → 青色リトマス紙が赤に変化
H+は正の電荷なので陰極(−極)へ移動 → 陰極側の青色リトマス紙が赤に変わる(図の左下の○)
5. ろ紙に食塩水をしみこませる理由(実験のポイント)
なぜろ紙に食塩水をしみこませるのか?
食塩(NaCl)は水に溶けるとイオン(Na+ と Cl–)になり、電気を通しやすい「電解質」になります。ろ紙全体に食塩水をしみこませることで、電流が流れやすくなり、酸やアルカリから出たイオン(H+ や OH–)が移動しやすくなります。これにより、しみの移動やリトマス紙の色変化を観察しやすくなります。
※ 食塩水以外に、硝酸カリウム(KNO3)水溶液など、他の電解質を使うこともあります。実験の条件に合わせて選びましょう。
6. 実験時の注意点(安全・観察のコツ)
- 塩酸や濃い NaOH は刺激が強く、皮膚や目に有害です。取り扱いは必ず手袋・保護メガネを着用し、換気の良い場所で行うこと。
- 電源は低電圧に設定し、短時間で観察する。高電圧を長時間かけると試験紙が焦げたり、予期しない分解が起きる可能性がある。
- 色の判定は周囲の明るさに左右されるため、同じ明るさの場所で比較する。写真を撮る場合はホワイトバランスに注意。
- 観察結果はなるべく定量的に記録する(「右側が青に変わった」「左側のしみが移動した」などの図示や時間の記録を残す)。
7. まとめ(入試で押さえるべきポイント)
- 酸は H+ を出す → H+ は陰極(−極)へ移動
- アルカリは OH– を出す → OH– は陽極(+極)へ移動
- アルカリ性:赤色リトマス紙が青に変わる/酸性:青色リトマス紙が赤に変わる
- ろ紙に食塩水をしみこませるのは、電流を通しやすくしてイオンの移動を観察しやすくするため
この流れを理解しておけば、「電気」と「酸・アルカリ」が組み合わさった入試問題でも落ち着いて解答できます。必要なら、このHTMLをもとに実験手順書(簡易マニュアル)や、入試想定問題(図つき)も作成します。希望があれば言ってください。

コメント